武汉伊莱瑞特生物科技股份有限公司品牌商
12 年
手机商铺
- NaN
- 0.7000000000000002
- 0.7000000000000002
- 2.7
- 2.7
推荐产品
公司新闻/正文
Elabscience 解密流式实验:死细胞才是高背景 “元凶”,这样破解超高效!
65 人阅读发布时间:2025-12-16 15:21
您的流式图是不是经常荧光乱飘、细胞分群像打了马赛克、阳性阴性傻傻分不清?这可能不是手抖,也不是抗体选错,而是忽略了潜伏在实验中的“干扰大师”——死细胞。
没错,就是这些看似无害的死细胞,正在悄悄搅乱您的数据!不过别慌,今天Elabscience来帮您厘清死细胞对流式实验的影响,为您提供清晰、有效的破解之道!
死细胞对流式实验会造成哪些影响?
1. 非特异性结合:死细胞的细胞膜通透性增加,完整性受损。它们会像一块“小海绵”非特异性地结合抗体和荧光素,导致结果出现非特异性染色,显著抬高荧光背景。这样会导致目标阳性群信号被淹没在一片高背景中,实验结果假阳性率升高,细胞分群模糊不清。
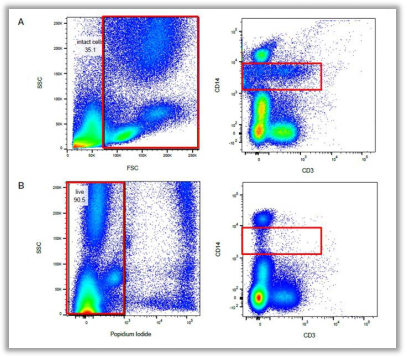
Fig. 1. 相同样本排除死细胞前后结果对比(A组未加死活染料染色,B组加入PI染料进行染色)
2. 自发荧光干扰:死细胞会导致背景自发荧光增强,其信号强度甚至可能超过某些荧光素的真实信号。这对于弱表达抗原或不分群指标的检测结果会有较大的影响。并且死细胞产生的荧光波长没有选择性,可被多个通道检测,在有的图上会表现为沿对角线分布的信号。这也是识别死细胞干扰的一个重要特征。
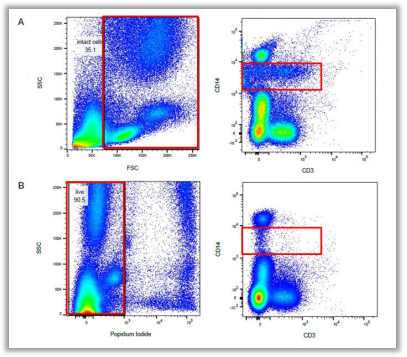
Fig. 2. 死细胞干扰特征示意图。死细胞在图上沿对角线分布(Dead cells)
如何有效去除死细胞的影响?
排除死细胞的关键是使用死活细胞鉴定染料。目前主要的死活鉴定染料分为核酸染料和胺基染料,它们的原理不同,适用场景各异。
1. 核酸染料(适用于未固定样本)
该方法的原理基于活细胞膜的完整性:活细胞因膜结构保持完整,具有选择透过性,使得PI、7-AAD、DAPI这类核染料无法进入细胞内部,因此不会显现荧光;而死细胞由于膜已破损,染料可进入细胞内并与核酸结合,从而发出荧光。使用时,在完成流式抗体染色后,于上机前加入核酸染料并进行短暂孵育。
需要注意的是:若实验后续需进行固定处理,固定过程会破坏所有细胞的膜结构,导致活细胞亦呈阳性信号,故此方法在后续要进行固定处理的情况下不适用。
2. 胺基染料(适用于需固定的实验)
该方法的原理是通过染料与蛋白质伯氨基的共价结合实现的:活细胞因仅与细胞膜表面蛋白结合,荧光信号较弱;而死细胞由于细胞膜破损,染料可结合胞内大量蛋白,因此荧光信号较强。使用时,在流式抗体染色前进行死活细胞染色,清洗后细胞可继续进行固定和破膜操作,且其荧光信号不会丢失。
不同样本如何选择?
并非所有样本都必须要进行死活染色。根据我们的经验,为您提供以下实操建议:
1. 新鲜外周血/骨髓样本:一般死细胞较少,可以不做。但若不太新鲜或处理不当,仍建议染色。
2. 脾脏/淋巴结等组织:样本制备难度相对容易,可根据单细胞悬液的质量决定。若镜下可见较多碎片,建议进行染色。
3. 难制备的组织/肿瘤样本:死细胞通常特别多,建议一定要做!
4. 多色流式实验:建议进行死活染色。这是降低背景、提高数据质量的关键步骤,需注意染料通道与抗体panel的兼容性。
产品推荐
我们可提供多种核酸染料及胺基染料,全面满足您从基础表面标记到复杂多色胞内染色的各类需求。
|
产品名称 |
货号 |
产品规格 |
用途 |
|
碘化丙啶(PI)染色液 |
E-CK-A161 |
50/100/200/500 T |
细胞内DNA染色 |
|
7-氨基放-线菌素D(7-AAD)染色液 |
E-CK-A162 |
50/100/200/500 T |
细胞内DNA染色 |
|
4',6-二脒基-2-苯基吲哚二盐酸-盐(DAPI)染色液 |
E-CK-A163 |
50/100/200/500 T |
细胞内DNA染色 |
|
STYX™ Green Fixable Viability Kit |
E-CK-A166 |
50/100/200 T |
鉴定细胞死活状态,区分死活细胞 |
|
STYX™ Violet Fixable Viability Kit |
E-CK-A167 |
50/100/200 T |
鉴定细胞死活状态,区分死活细胞 |
是不是没想到,小小的死细胞,竟有这么大的破坏力?下次做流式实验,记得正确使用死活染料,获得高质量、可重复流式数据!
欢迎在评论区分享您在流式实验中遇到的问题与心得,关注Elabscience®,获取更多实验技巧与解决方案哦~


![FITC Anti-Mouse CD3 Antibody流式抗体[17A2]](https://img1.dxycdn.com/p/s14/2025/0609/471/0481799173518002391.png!wh200)
![FITC 标记抗小鼠/人 CD11b 抗体-流式抗体[M1/70]_货号:E-AB-F1081C](https://img1.dxycdn.com/p/s14/2025/0609/740/6904673901537002391.png!wh200)